
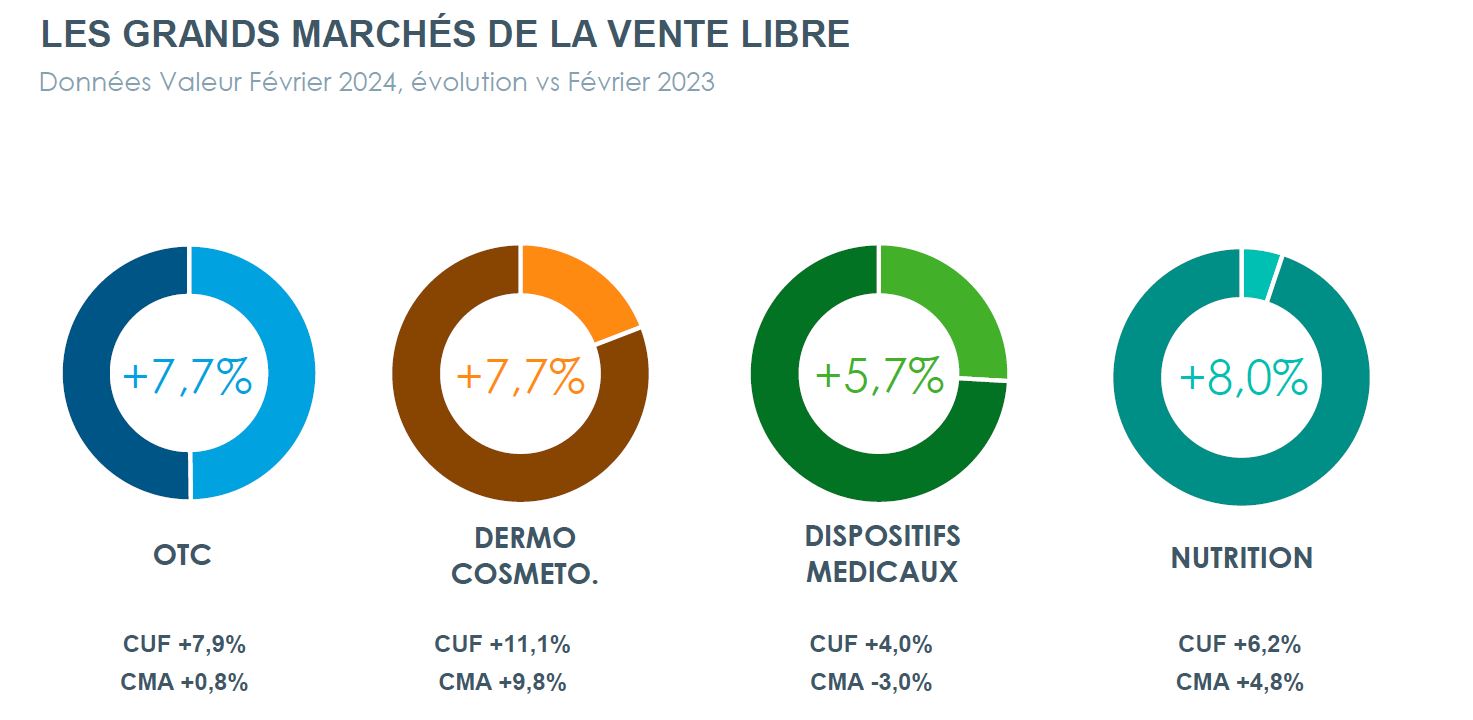
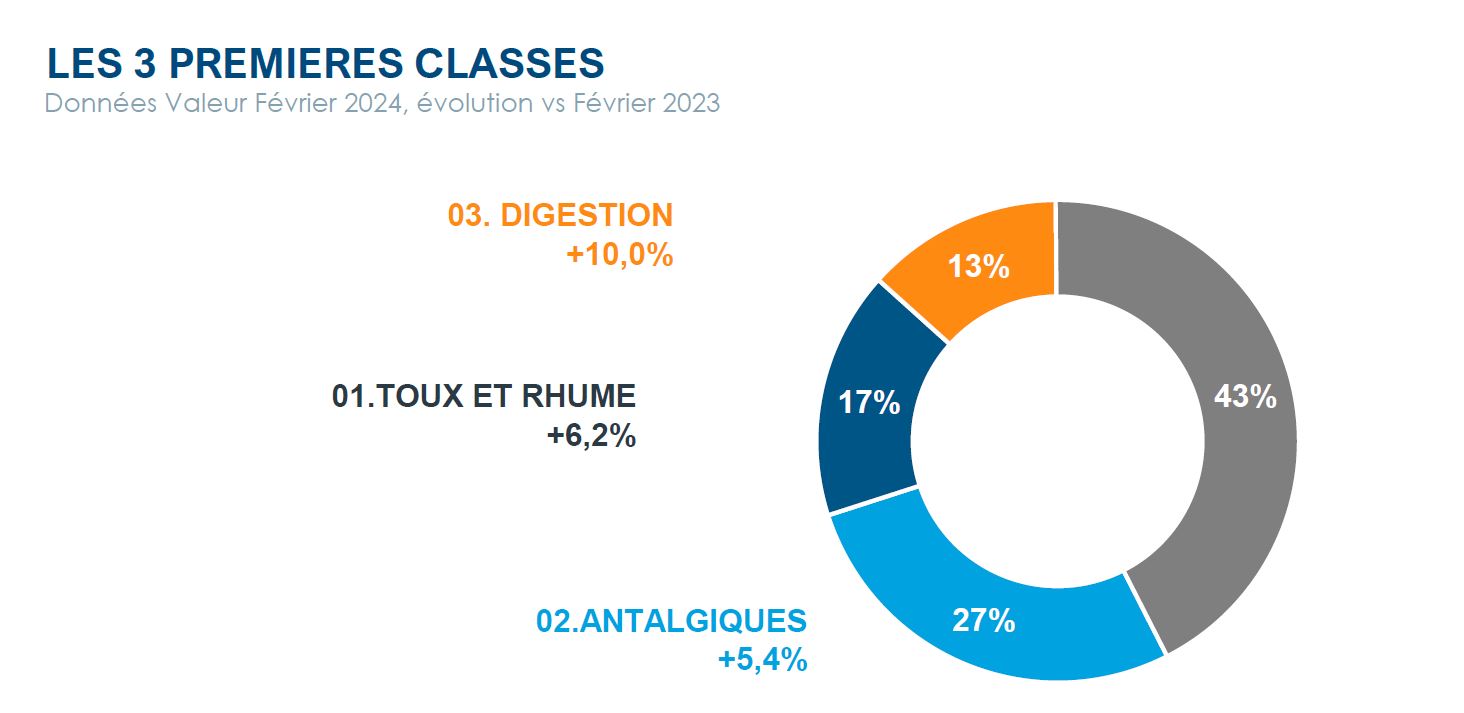
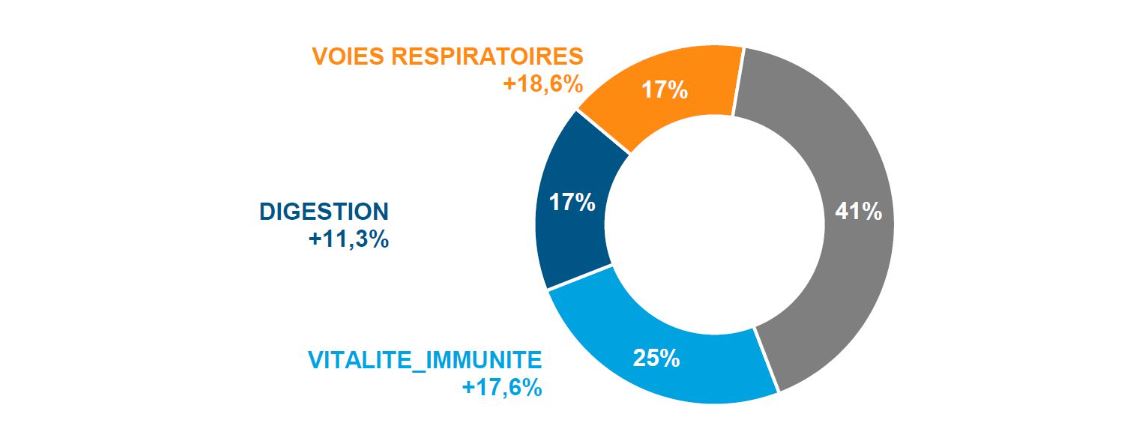
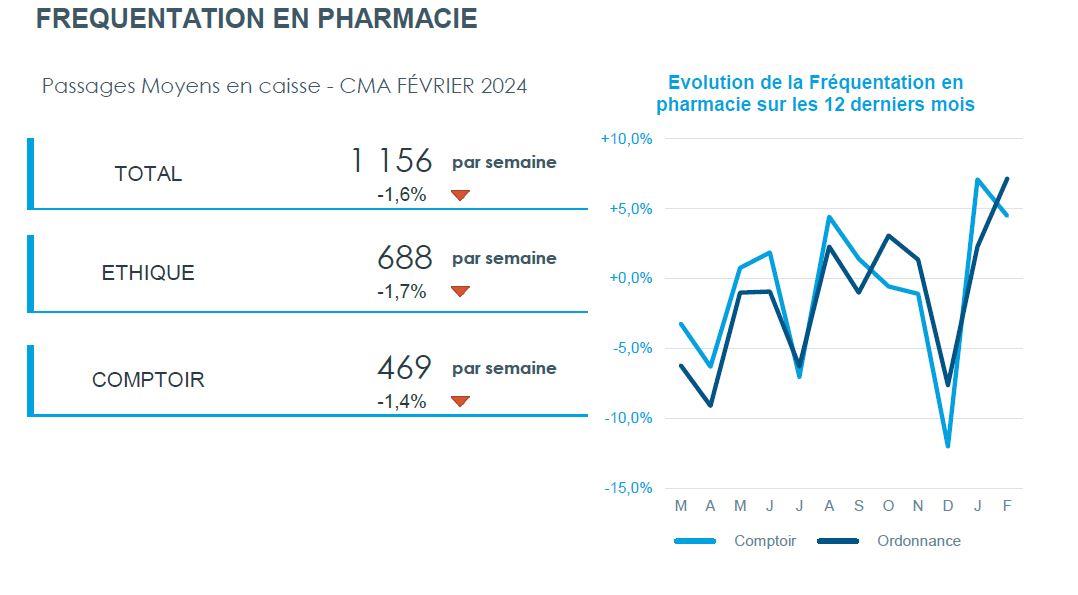
Marché de la vente libre en France

EU HTA : Un tournant stratégique pour l’évaluation
Avec l’entrée en vigueur, le 12 janvier, de la première phase du règlement EU HTA, l’Union
européenne se dote d’un cadre commun pour harmoniser les évaluations HTA des
innovations médicales. Chaque laboratoire qui déposera auprès de l'Agence européenne
des médicaments une demande d'AMM pour un nouvel anticancéreux ou médicament de
thérapie innovante devra en parallèle déposer un dossier d'évaluation clinique commune
(Joint Clinical Assessment JCA). Ce document contiendra les données nécessaires, analyses
comparatives (PICOs), à la réalisation du JCA.
En 2025, pas moins de 25 JCAs sont attendues, dont 17 sur des traitements du cancer et 8
sur des médicaments de thérapie innovante. Ces évaluations seront réalisées au niveau
européen par les agences nationales de santé des États membres. Un nouveau rôle
qu'entend jouer pleinement la HAS : selon un récent article des Echos, l'autorité française
ambitionne d'être co-rapporteuse de la moitié de ces évaluations cette année. Pour les
laboratoires, le calendrier n'en demeure pas moins exigeant. Après une phase de scoping et
de définition des PICOs attendus par les autorités de santé, ils disposeront de 100 jours
pour constituer et soumettre leur dossier. Le défi majeur reste ainsi la coordination et la
consolidation des demandes de PICOs dans des délais contraints : le rapport final JCA doit
être disponible dans les 30 jours suivants l’AMM, avant une seconde étape, cette fois
nationale, d'appréciation de la valeur ajoutée du produit afin d'établir son niveau de
remboursement.
Les industriels pourront également solliciter, de façon optionnelle, un avis scientifique sur le
protocole de leur étude pivot (Joint Scientific Consultation JSC). La 1ère période de dépôt
des demandes pourra se faire en février, suivie d’une 2e en juin. Environ 10 de JSC sont
ainsi anticipés pour 2025 (7 pour les médicaments et 3 pour les DM).
Valentine Berthet

